El átomo de carbono se une a otros átomos mediante enlaces esencialmente covalentes, orientados simétricamente en el espacio. Si unimos un átomo de carbono con otros cuatro átomos de carbono y, a su vez, cada uno de ellos se une a otros átomos de carbono, todos lograrán, compartiendo electrones, alcanzar los ocho electrones que necesitan en su capa exterior. Es más, los enlaces del átomo de carbono con otros átomos suelen encontrarse en la dirección de los vértices de un tetraedro regular.
Por ejemplo, el carbono une sus cuatro electrones con el hidrógeno, formando una serie de compuestos muy estables. El más simple es el CH4 que recibe el nombre de metano. Los electrones compartidos con el hidrógeno forman un enlace covalente. Con el átomo de oxígeno el carbono forma el CO2 (bióxido de carbono), compartiendo dos pares de electrones a la vez.
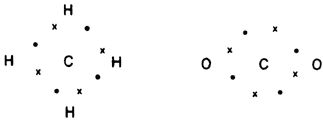
Compuestos hidrogenados de nitrógeno
El amoníaco (NH3) es uno de los compuestos mas importantes de nitrógeno. Es un gas tóxico incoloro que tiene un olor irritante característico. En el laboratorio se puede preparar por la acción del NaOH con una sal de amonio (NH4). El ion NH4+ que es el ácido conjugado del amoniaco (NH3) transfiere un protón al OH-. El NH3 resultante es volátil y se expulsa de la solución por calentamiento moderado:
NH4Cl (ac) + NaOH (ac) NH3 (g) + H2O (l) + NaCl (ac)
El amoníaco (NH3) es uno de los compuestos mas importantes de nitrógeno. Es un gas tóxico incoloro que tiene un olor irritante característico. En el laboratorio se puede preparar por la acción del NaOH con una sal de amonio (NH4). El ion NH4+ que es el ácido conjugado del amoniaco (NH3) transfiere un protón al OH-. El NH3 resultante es volátil y se expulsa de la solución por calentamiento moderado:
NH4Cl (ac) + NaOH (ac) NH3 (g) + H2O (l) + NaCl (ac)
La producción comercial de NH3 se lleva a cabo por el proceso Haber:
N2 (g) + 3 H2 (g) 2 NH3 (g)
N2 (g) + 3 H2 (g) 2 NH3 (g)
Oxidos y oxiácidos de nitrógeno
El nitrógeno forma tres óxidos comunes:
El nitrógeno forma tres óxidos comunes:
- Oxido nitroso (N2O): se conoce también como gas hilarante, gas incoloro, fue la primera sustancia utilizada como anestésico general. Se emplea como gas comprimido en varios aerosoles y espumas. Se lo puede preparar en el laboratorio por calentamiento de amonio (NH4NO3) a 200°.
NH4NO3 (s) N2O (g) + 2 H2O (g)
- Oxido nítrico (NO): gas incoloro pero a diferencia del oxido nitroso, es ligeramente tóxico. Se lo puede preparar en el laboratorio por reducción del ácido nítrico usando cobre o hierro como agente reductor.
3 Cu (s) + 2 NO3-(ac) + 8 H+ (ac) 3 Cu+2 (ac) + 2 NO (g) + 4 H2O (l)
- Dióxido de nitrógeno (NO2): gas de color amarillento constituyente importante del smog, venenoso y de olor asfixiante.
Los dos oxiácidos comunes del nitrógeno son:
- Acido nítrico (NO3): liquido corrosivo incoloro, las soluciones suelen tomar un color ligeramente amarillento como resultado de la formación de pequeñas cantidades de NO2. por descomposición fotoquimica. Es un ácido fuerte y poderoso agente oxidante, ataca casi todos los metales excepto el oro (Au) y platino (Pt)
4 NH3 (ac) 4 NO2 (g) + O2 (g) + 2 H2O (l)
- Acido nitroso (HNO2): menos estable que el ácido nítrico, se produce normalmente por la acción de un ácido fuerte como el ácido sulfúrico (H2SO4) sobre una solución fría de una sal de nitrito como en nitrito de sodio (NaNO2).
El oxigeno se puede obtener ya sea del aire o de compuestos que lo contienen. Casi todo el oxigeno comercial se obtiene por destilación fraccionada de aire licuado.
Un método común de laboratorio para obtenerlo es la descomposición térmica de clorato de potasio (KClO3) con dióxido de manganeso (MnO2) como catalizador:
2 KclO3 (s) 2K Cl (s) + 3 O2 (g)
Un método común de laboratorio para obtenerlo es la descomposición térmica de clorato de potasio (KClO3) con dióxido de manganeso (MnO2) como catalizador:
2 KclO3 (s) 2K Cl (s) + 3 O2 (g)
Al igual que el H2, el O2 se puede recoger por desplazamiento del agua gracias a que su solubilidad es relativamente baja
Gran parte del oxigeno de la atmósfera repone a través del proceso fotosintético por lo tanto este proceso no solo regenera oxigeno sin que consume dióxido de carbono (CO2).
Es una de las sustancias químicas industriales de mayor uso (en EEUU se consumen 24 millones de ton/año). Se lo transporta y almacena ya sea en forma liquida o en recipientes de acero en forma de gas comprimido. Sin embargo, el 70% de la producción de oxigeno se genera en el lugar donde va a ser utilizado.
Gran parte del oxigeno de la atmósfera repone a través del proceso fotosintético por lo tanto este proceso no solo regenera oxigeno sin que consume dióxido de carbono (CO2).
Es una de las sustancias químicas industriales de mayor uso (en EEUU se consumen 24 millones de ton/año). Se lo transporta y almacena ya sea en forma liquida o en recipientes de acero en forma de gas comprimido. Sin embargo, el 70% de la producción de oxigeno se genera en el lugar donde va a ser utilizado.
Es el agente oxidaste mas extendido, mas de la mitad de lo que se produce se lo utiliza en la industria acerera principalmente para eliminar impurezas del metal.
Oxidos
La electronegatividad del oxigeno solo es inferior a la del flúor, por lo tanto exhibe todos los estados de oxidación negativos en todos los compuestos excepto los que tienen flúor
El estado de oxidación –2 es el mas común. Los no metales forman óxidos covalentes, son moléculas sencillas con puntos de fusión y ebullición bajos, la mayoría de los óxidos no metálicos se combinan con el agua para formar oxiacidos. Por ejemplo: el dióxido de azufre (SO2) se disuelve en agua para formar ácido sulfuroso (H2SO3)
SO2 (g) + H2O (a.C.) H2SO3 (a.C.)
Los óxidos que reaccionan con agua para formar ácidos se llaman anhidro ácidos (anhidro significa sin agua) u óxidos ácidos.
Casi todos los óxidos metálicos son compuestos ionicos, estos óxidos ionicos que se disuelven en agua reaccionan para formar hidroxidos y se conocen como anhidridos basicos u oxidos basicos. Por ejemplo: el oxido de bario (BaO) reacciona con el agua para formar hidróxido de bario Ba(OH)2.
BaO (s) + H2O (l) Ba(OH)2 (ac)
La electronegatividad del oxigeno solo es inferior a la del flúor, por lo tanto exhibe todos los estados de oxidación negativos en todos los compuestos excepto los que tienen flúor
El estado de oxidación –2 es el mas común. Los no metales forman óxidos covalentes, son moléculas sencillas con puntos de fusión y ebullición bajos, la mayoría de los óxidos no metálicos se combinan con el agua para formar oxiacidos. Por ejemplo: el dióxido de azufre (SO2) se disuelve en agua para formar ácido sulfuroso (H2SO3)
SO2 (g) + H2O (a.C.) H2SO3 (a.C.)
Los óxidos que reaccionan con agua para formar ácidos se llaman anhidro ácidos (anhidro significa sin agua) u óxidos ácidos.
Casi todos los óxidos metálicos son compuestos ionicos, estos óxidos ionicos que se disuelven en agua reaccionan para formar hidroxidos y se conocen como anhidridos basicos u oxidos basicos. Por ejemplo: el oxido de bario (BaO) reacciona con el agua para formar hidróxido de bario Ba(OH)2.
BaO (s) + H2O (l) Ba(OH)2 (ac)
Peróxido y superóxidos
Los compuestos que contienen enlaces O-O y con estado oxidación –1 se denominan peróxidos.
El oxigeno tiene un estado de oxidación de –1/2 se llaman en O2- se conoce como ion superoxido.
Los compuestos que contienen enlaces O-O y con estado oxidación –1 se denominan peróxidos.
El oxigeno tiene un estado de oxidación de –1/2 se llaman en O2- se conoce como ion superoxido.
Ozono
Es un gas venenoso de color azul pálido con marcado olor irritante. La exposición de 0,1 a 1 ppm produce dolor de cabeza, ardor de ojos, irritación de las vais respiratorias, etc.
El ozono se disocia fácilmente y forma átomos de oxigeno reactivas:
O3 (g) O2 (g) + O (g)
Es un gas venenoso de color azul pálido con marcado olor irritante. La exposición de 0,1 a 1 ppm produce dolor de cabeza, ardor de ojos, irritación de las vais respiratorias, etc.
El ozono se disocia fácilmente y forma átomos de oxigeno reactivas:
O3 (g) O2 (g) + O (g)
Es un agente oxidante mas fuerte que el oxigeno, una medida de este poder oxidante es el alto potencial estándar de reducción del ozono en comparación con el oxigeno
O3 (g) + 2 H+ (ac) + 2 e- O2 (g) + H2O (l) E° 2.07
O2 (g) + 4 H+ (ac) + 4 e- 2 H2O (l) E° 1.23
O3 (g) + 2 H+ (ac) + 2 e- O2 (g) + H2O (l) E° 2.07
O2 (g) + 4 H+ (ac) + 4 e- 2 H2O (l) E° 1.23
Forma ácidos con muchos elementos en condiciones en las que el oxigeno no reacciona, de hecho oxida todos los metales excepto el oro y platino.
Los usos de ozono como sustancia química industrial son relativamente limitados, se usa en ciertas ocasiones para el tratamiento de agua domestica en lugar del cloro, eliminando de esta forma microorganismos como bacterias y para oxidar materia orgánica.
Sí es muy utilizado en la industria farmeacéutica y en la preparación de compuestos orgánicos donde el ozono rompe los dobles enlaces carbono carbono.
Los usos de ozono como sustancia química industrial son relativamente limitados, se usa en ciertas ocasiones para el tratamiento de agua domestica en lugar del cloro, eliminando de esta forma microorganismos como bacterias y para oxidar materia orgánica.
Sí es muy utilizado en la industria farmeacéutica y en la preparación de compuestos orgánicos donde el ozono rompe los dobles enlaces carbono carbono.
Química ambiental
La cantidad de O2 disuelto en el agua es un indicador de la calidad de la misma. El agua completamente saturada de aire a 1 atm. Y 20° contiene alrededor de 9 ppm de oxigeno.
Es necesario para todas formas de vida, que las bacterias aeróbias consuman oxigeno disuelto para oxidar materia orgánica y satisfacer así sus necesidades energéticas.
El material orgánico que las bacterias son capaces de oxidar es biodegradable, esta oxidación ocurre a través de un conjunto de reacciones químicas y el material orgánico desaparece gradualmente.
Las cantidades excesivas de materiales orgánicos biodegradables en el agua son perjudiciales porque agotan en el agua el oxigeno necesario para sustentar la vida en ella. Estos materiales biodegradables se conocen como desechos de demandan oxigeno. Las fuentes típicas de desechos que demandan oxigeno son las aguas residuales, desechos industriales de plantas procesadores de alimentos, papel, etc.
La cantidad de O2 disuelto en el agua es un indicador de la calidad de la misma. El agua completamente saturada de aire a 1 atm. Y 20° contiene alrededor de 9 ppm de oxigeno.
Es necesario para todas formas de vida, que las bacterias aeróbias consuman oxigeno disuelto para oxidar materia orgánica y satisfacer así sus necesidades energéticas.
El material orgánico que las bacterias son capaces de oxidar es biodegradable, esta oxidación ocurre a través de un conjunto de reacciones químicas y el material orgánico desaparece gradualmente.
Las cantidades excesivas de materiales orgánicos biodegradables en el agua son perjudiciales porque agotan en el agua el oxigeno necesario para sustentar la vida en ella. Estos materiales biodegradables se conocen como desechos de demandan oxigeno. Las fuentes típicas de desechos que demandan oxigeno son las aguas residuales, desechos industriales de plantas procesadores de alimentos, papel, etc.
En presencia de oxigeno, el carbono, hidrogeno, nitrógeno, azufre y fósforo del material biodegradable se convierten en CO2, HCO3-, H2O, NO3-, SO4 –2 y PO4 –3.
No hay comentarios:
Publicar un comentario